
DIESE (Dispositifs d’Imagerie pour l’Etude des Systèmes Environnementaux) rassemble les équipements d’imagerie, les compétences scientifiques et techniques pour les projets scientifiques dédiés à l’étude des interactions entre contaminants (nanoparticules, métaux, pesticides, molécules médicamenteuses), cellules (micro-organismes, cellules animales et végétales) et tissus. Nous disposons d’un large panels d’outils analytiques et de microscopes autorisant mesures spectrales et imageries sur des échelles spatiales allant du centimétrique à l’infra-micronique.
Le projet MIRAGE a contribué au financement d'une partie des équipements de cette plateforme.
Responsables : Isabelle Bihannic (IR,Nancy-Charmois), Bénédicte Sohm (IR, Metz-Bridoux)

Microscopie confocale à balayage laser et modalités d’imagerie associées
Responsable Isabelle Bihannic
Principe
La microscopie confocale à balayage laser consiste à collecter, point par point, le signal de fluorescence émis lors de l’excitation d’un fluorophore au cours du balayage laser. Lorsque l’objet à étudier ne possède pas de molécules autofluorescentes (comme par exemple la chlorophylle), il est nécessaire d’avoir recours à un marqueur qui vient se combiner de façon spécifique à la molécule à imager (ADN, lipides…). Le fluorochrome peut aussi être une protéine recombinante produite in situ par la cellule elle-même (par ex. GFP produite par des organismes génétiquement modifiés).
Equipement
Microscope inversé (ZEISS Axio observer 7), équipé d’une tête de balayage LSM 880.
Chambre environnementale permettant de contrôler température et CO2.
Lasers :
- Diode laser 405 nm
- Laser argon (458 nm, 488 nm, 514 nm)
- Diode laser 561 nm
- Laser HeNe 633 nm
- Laser pulsé IR (COHERENT – CHAMELEON DISCOVERY) accordable entre 660 nm et 1320 nm.
Objectifs :
- 10x Plan Neofluar 10x/0.3
- 20x Plan Apochromat 20x/0.8 DIC
- 40x Plan Apochromat 40x/0.95 DIC
- 63x Plan Apochromat 60x/1.4 Huile DIC
Détecteurs :
- Détection interne : 2 PMT et détecteur spectral 32 canaux (GaAsP) pour mesures spectrales
- Détection externe (NDD) : BIG 2 (GaAsP)
- Détection haute résolution en mode AiryScan.
Application
Imagerie de fluorescence 2D et 3D.
Imagerie spectrale
Imagerie haute résolution (mode AiryScan)
Imagerie bi-photon
Autres modalités
- FLIM (Fluorescence Lifetime Imaging Microscopy). Le microscope confocal LSM 880 est équipé d’un laser IR pulsé accordable de 660 à 1320 nm (CHAMLELEON DISCOREY COHERENT), ainsi que de deux diodes pulsées (405 nm et 488 nm), permettant les mesures de durée de vie de fluorescence dont la détection est faite au moyen d’un détecteur spectral (Becker & Hickl). La durée de vie de fluorescence correspond au temps moyen pendant lequel une molécule fluorescente demeure excitée. Ce temps caractéristique dépend de l’environnement du fluorophore et sa mesure permet d’accéder à paramètres environnementaux à l’échelle locale (pH, concentration en oxygène, ions Ca++). Cette technique permet également de caractériser l’autofluorescence, ou encore des changements conformationnels.
- Microscopies non linéaires. Les techniques de microscopie non linéaires sont basées sur des effets d’optique non-linéaires, qui conduisent, dans certaines conditions particulières, à la production de photons dont l’énergie est double (génération de seconde harmonique-SHG) ou triple (génération de troisième harmonique-THG) par rapport aux photons initiaux. Ce type de microscopie sans marquage n’implique pas l’excitation de molécules, contrairement à la microscopie de fluorescence. Par conséquent, les molécules ne subissent pas d'effets de phototoxicité ou de photoblanchiment. Peu invasive, cette technique d’imagerie est sensible à l’organisation macromoléculaire du milieu, et permet notamment d’imager sans marquage des molécules possédant des propriétés de non centrosymétrie telle que le collagène fibrillaire ou encore l’amidon. Elle permet également de visualiser des surfaces minérales. La source laser utilisée est un laser pulsé infra-rouge (CHAMELEON DISCOVERY-COHERENT).
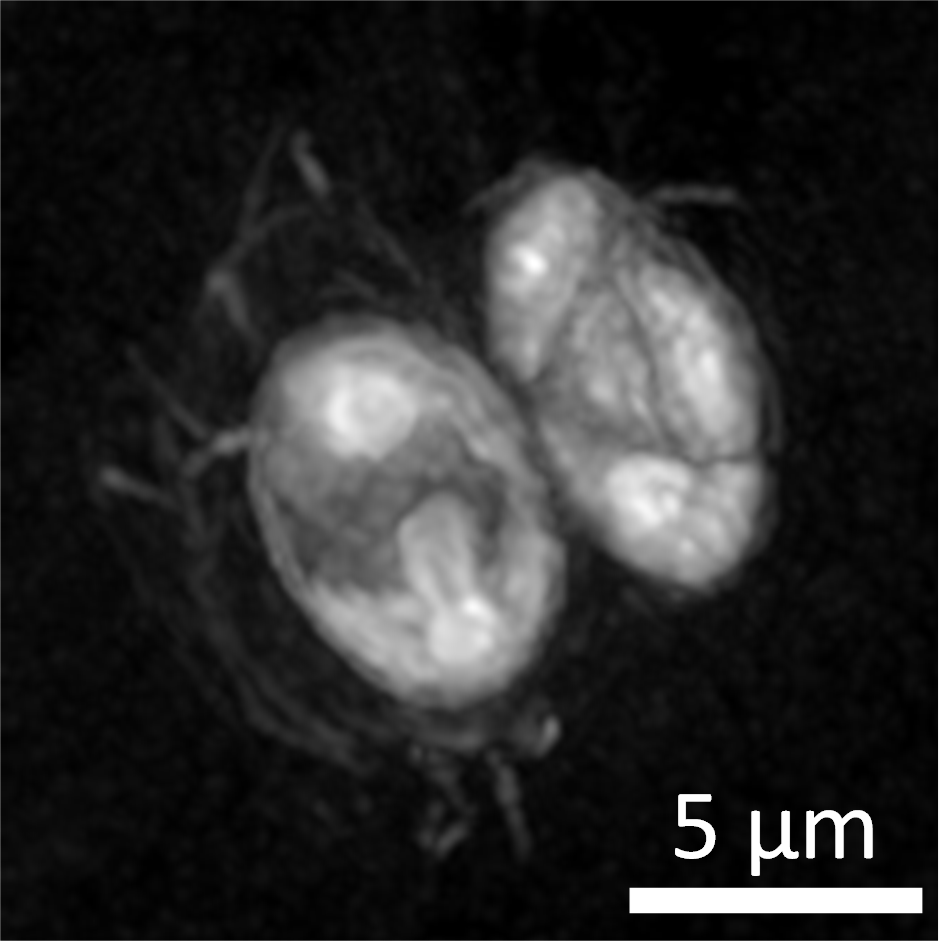
Microscopie quantitative de phase 2D – Holotomographie
Responsable Isabelle Bihannic
Principe
La microscopie quantitative de phase est une technique d’imagerie interférométrique qui permet d’observer en 2D ou 3D et sans marquage tout objet biologique semi-transparent d’épaisseur inférieure à 40 µm (micro-organisme de type bactérie, micro-algue, levure, biofilm, cellules végétale ou animale). Outre l’intérêt de la technique pour collecter rapidement , avec une résolution descendant à quelques dizaines de nanomètres, des informations morphologiques (taille et forme des objets, arrangement de cellules ou transport et distribution de nanoparticules au sein de biofilms), un avantage majeur de ce mode d’imagerie réside dans le fait que chaque pixel code une information quantitative, donnant ainsi la possibilité de déduire des données biophysiques et biochimiques sur l’état des cellules (masse sèche, quantification du contenu lipidique de microalgues, évaluation de l’état d’inflammation de cellules…). L’enregistrement de séries temporelles est possible.
Equipements
2D
Nous disposons d’une caméra interférométrique (modèle SID4-sC8 de marque PHASICS) qui peut être montée sur tout port C de microscope.
- Type de capteur : sCMOS
- Gamme de longueur d’onde : 450 – 1000 nm
- Nombre de pixels des images d’intensité et de phase : 852 x 720
- Taille des pixels (sans grossissement) : 19.5 μm
- Résolution sur la phase : 1 nm
3D (Holotomographie)
Les observations en 3D sont réalisées au moyen du microscope HT2 de marque TOMOCUBE, qui permet le couplage entre holotomographie et microscopie de fluorescence. Le principe de l’holotomographie consiste à enregistrer une pile d’images collectées à différents angles d’incidence du faisceau laser par rapport à l’échantillon. A partir de cette pile d’images, un volume 3D est reconstruit de façon numérique.
Les spécifications techniques de l’appareil sont les suivantes:
- Objectif : Immersion à eau, 60X, 1.2 d’ouverture numérique
- Condenseur : Immersion à eau, 60X, 1.2 d’ouverture numérique
- Taille du champ : 80 x 80 µm² au maximum
- Profondeur de champ : 40 µm au maximum
- Vitesse d’acquisition : 150 fps (2D)/ 2.5 fps (3D)
Mode holotomographie
- Source lumineuse : Laser 532 nm
- Résolution latérale : 110 nm
- Résolution axiale : 356 nm
- Taille voxel reconstruit : 110 nm en latéral, 220 nm en axial
Mode Fluo
- Source lumineuse : LED (3 canaux, DAPI/GFP/mCherry)
- Résolution latérale : 220 nm

